Taką dostałam wiadomość od mojej kursantki: ,,Kwas etanowy jest dobrze rozpuszczalny w wodzie i jest słabym kwasem czyli zgodnie z tym CH3COOK wywodzi się od słabego kwasu i mocnej zasady. To dlaczego zakładamy, że właśnie ten stopień dysocjacji będzie wynosił 100%? Jeśli CH3COOK byłby mocnym elektrolitem to nie ulegałby hydrolizie… (…). Bazując na poprzednich przykładach, jeśli coś wywodzi się od słabego kwasu/zasady i mocnego kwasu/zasady to mamy słaby elektrolit stąd też właśnie moja zagwozdka…”
Z lat doświadczeń wiem, że to częsty problem, więc postanowiłam napisać krótki wpis na ten temat 😉
Sole
Sole to związki chemiczne zbudowane z kationów metali (lub kationu amonu) i anionów reszt kwasowych. Pomiędzy kationami, a anionami występują wiązania jonowe, zatem po wprowadzeniu soli do wody po jej całkowitym lub częściowym nawet rozpuszczeniu następuje proces dysocjacji jonowej – cząsteczki wody asocjują kationy i aniony separując te od siebie i niwelując oddziaływania elektrostatyczne kation-anion w soli. Kryształy jonowe bardzo dobrze dysocjują, to proces ten zachodzi w 100%, stąd też sole są bardzo dobrymi elektrolitami.
Podczas rozpuszczenia wielu soli w wodzie obserwujemy zakwaszenie lub alkalizowanie roztworu wodnego. Wynika to z zachodzących reakcji protolizy – niektóre spośród kationów lub anionów uwalnianych do roztworu w trakcie procesu dysocjacji ulegają dalszej reakcji z wodą – jest to dysocjacja kwasowa (hydroliza kationowa) lub dysocjacja zasadowa (hydroliza anionowa). Z wodą nie będą natomiast reagować jony pochodzące od mocnych kwasów lub zasad.
Przykłady
Przeanalizujmy trzy sole: chlorek amonu, octan sodu i chlorek sodu. Wszystkie te trzy sole to kryształy jonowe – więc po umieszczeniu w wodzie będą one dysocjowały w 100%. Fakt ten obrazują poniższe równania reakcji chemicznych:
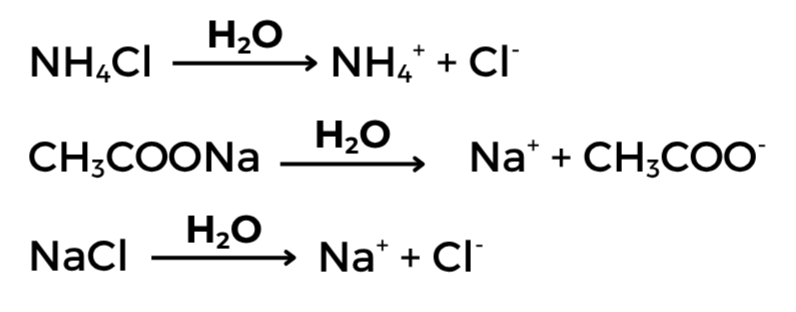
Spośród powstających jonów, te które w myśl teorii Brønsteda-Lowry’ego są słabymi kwasami lub zasadami będą reagować dalej z wodą, która będzie zachowywała się kolejno jak słaba zasada lub słaby kwas.
Kation NH4+ w obecności wody zachowuje się jak kwas (oddaje cząsteczce wody proton, która pełni tu funkcję zasady).
NH4+ + H2O ⇄ NH3 + H3O+ dysocjacja kwasowa/ hydroliza kationowa
kwas1 zasada 2 zasada 1 kwas 2
Anion CH3COO– w obecności wody zachowuje się jak zasada (pobiera od cząsteczki wody proton, która pełni tu funkcję kwasu).
H2O + CH3COO– ⇄ OH− + CH3COOH dysocjacja zasadowa/ hydroliza anionowa
kwas1 zasada 2 zasada 1 kwas 2
Anion chlorkowy jako jon pochodzący z dysocjacji mocnego kwasu nie będzie dalej reagował z wodą – hydroliza nie ma miejsca. Kation sodu również nie reaguje z wodą, nie jest on ani kwasem ani zasadą w myśl teorii Brønsteda-Lowry’ego. W związku z tym zdysocjowany chlorek sodu (Na+ + Cl–) nie ulega procesowi hydrolizy.
Więcej informacji o dysocjacji znajdziesz tutaj.

