Co to jest wiązanie koordynacyjne i jak je rozpoznać?
Wiązanie koordynacyjne
Wiązanie koordynacyjne to rodzaj wiązania kowalencyjnego, w którym para uwspólnionych elektronów pochodzi od jednego atomu. Powstaje ono, gdy jeden z oddziałujących ze sobą atomów posiada już trwałą konfigurację elektronową gazu szlachetnego (czyli osiągnął oktet) i „udostępnia” swoją parę elektronową jako parę wspólną na rzecz atomu, który takiej pary „potrzebuje”.
Wiązanie koordynacyjne jest nazywane wiązaniem donorowo-akceptorowym. Donor, czyli atom będący dawcą pary elektronowej, wiąże się z akceptorem, czyli atomem, który przyjmuje tę parę elektronową. Wiązania koordynacyjne występują również w związkach kompleksowych (koordynacyjnych), zbudowanych z centralnego jonu metalu (który jest akceptorem par elektronowych) i otaczających go donorów par elektronowych (ligandów).
Wiązanie koordynacyjne – przykłady
Wiązanie koordynacyjne zaznacza się strzałką skierowaną w stronę od donora pary elektronowej do akceptora tej pary. Wiązanie koordynacyjne występuje, np. w jonie amonu NH4+ , czy też w cząsteczce kwasu azotowego(V) HNO3.


Wiązanie koordynacyjne występuje także w związkach koordynacyjnych, w których jon centralny jest akceptorem par elektronowej, a ligandy są donorami tych par.
Związki koordynacyjne to związki chemiczne w których centralny atom, lub jon metalu, otoczony jest zespołem ligandów (jony, lub cząsteczki obojętne, które posiadają przynajmniej jedną wolną parę elektronową, którą mogą uwspólnić). Przykłady związków koordynacyjnych to np. [Al(OH)4]– lub [Al(H2O)6]3+ czyli anion tetrahydroksoglinu oraz kation heksaakwaglinu. Liczbę ligandów bezpośrednio połączonych z atomem centralnym nazywamy liczbą koordynacyjną (LK). Tak więc w [Al(OH)4]– LK = 4, natomiast w [Al(H2O)6]3+ LK= 6.
Jak rozpoznać wiązanie koordynacyjne?
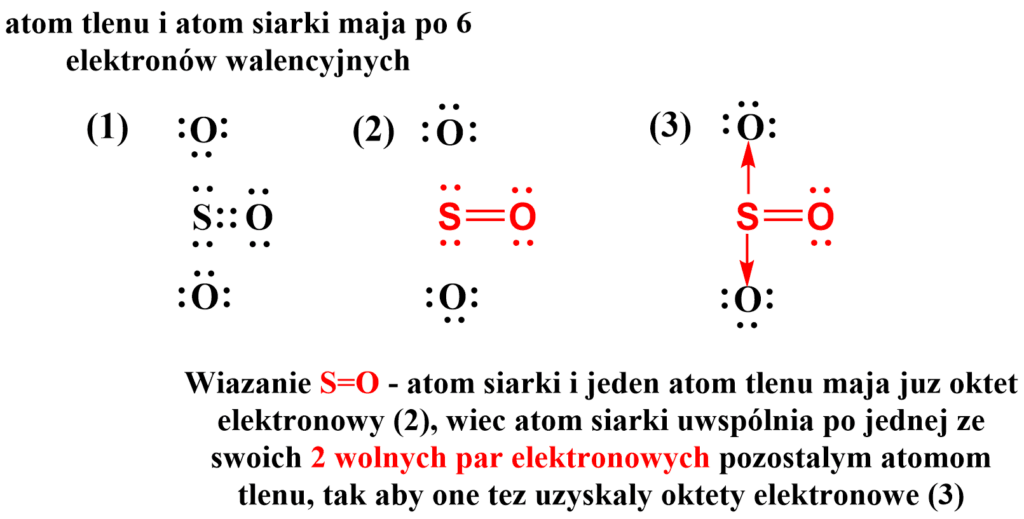
Zacznij od tego, aby rozrysować wzór elektronowy cząsteczki, która Cię interesuje. Rozważmy przypadek tlenku siarki(VI) SO3. W cząsteczce analizowanego związku chemicznego atom siarki uzyska oktet elektronowy po połączeniu się z jednym atomem tlenu za pomocą wiązania podwójnego. Co więcej, wspomniany atom tlenu również uzyska oktet elektronowy. Poza atomami, które uzyskały już oktet elektronowy, w cząsteczce występują jeszcze inne atomy, które nie mają oktetu elektronowego. Tutaj atom siarki powinien połączyć się jeszcze z dwoma atomami tlenu, które wciąż potrzebują po 1 parze elektronowej, aby uzyskać oktet elektronowy. W takim przypadku atom centralny, tu atom siarki, użycza każdemu atomowi tlenu jedną ze swoich wolnych par elektronowych, pozwalając uzyskać atomom tlenu oktet elektronowy, przy czym liczba elektronów atomu siarki nie ulega zmianie (czyli siarka już ma tyle elektronów ile chciała i nie chce ich mieć więcej, ale może się nimi podzielić). Dla tlenku siarki(VI) wygląda to następująco:

Wiązanie koordynacyjne występuje w takich związkach jak: BF4–, SO2, H2SO4, N2O5, CH3NO2, [Co(H2O)6]3+, O3, NH3BF3 i wielu innych.
Jak to wygląda w związkach koordynacyjnych*? (*Nie obowiązuje do matury, ale często o to pytacie). Na przykładzie K[Al(OH)4] oraz Al(H2O)6Cl3:
![rozpoznanie wiązania koordynacyjnego - przykład na K[Al(OH)4] oraz Al(H2O)6Cl3:](https://chemmaster.pl/wp-content/uploads/2023/07/KAlOH4-alh206Cl32cdxml-1-1024x233.png)
![rozpoznanie wiązania koordynacyjnego - przykład na K[Al(OH)4] oraz Al(H2O)6Cl3:](https://chemmaster.pl/wp-content/uploads/2023/07/KAlOH4-alh206Cl32cdxml-1-1024x233.png)
Zadania
Zadanie 1.
Istnieją związki, w których występują jednocześnie wiązania kowalencyjne spolaryzowane, koordynacyjne i jonowe. Spośród związków chemicznych wybierz te, które posiadają w swej strukturze wszystkie wymienione wiązania chemiczne:
Mg(OH)2, AlClF2, KNO2, NaNO3, Na2SO4, NH4Cl, Mg3(PO4)2, SO2,
Odpowiedź:
KNO2, NaNO3, Na2SO4, NH4Cl, Mg3(PO4)2
Zadanie 2.
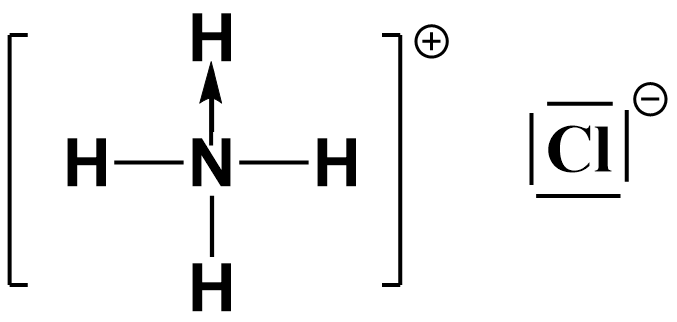
Spośród cząsteczek wymienionych w zadaniu 1 narysuj wzór elektronowy kreskowy drobiny, która zawiera w swojej strukturze wiązanie koordynacyjne i której atom będący donorem pary elektronowej ma najniższy stopień utlenienia spośród stopni utlenienia atomów będących donorami wiązania koordynacyjnego wymienionych drobin.
Odpowiedź:
Najniższy stopień utlenienia posiada atom azotu w chlorku amonu (-III).

Zadanie 3.
Uzupełnij zdania tak aby były one prawdziwe. W tym celu podkreśl poprawne sformułowania.
W cząsteczce tlenku siarki(IV) występuje 0/1/2 wiązania koordynacyjne. W wiązaniu koordynacyjnym wspólna para elektronowa pochodzi od jednego/dwóch z atomów tworzących to wiązanie. Donorem pary elektronowej jest atom o większej/mniejszej wartości elektroujemności względem wartości elektroujemności akceptora pary elektronowej. Wiązanie koordynacyjne jest wiązaniem typu kowalencyjnego/metalicznego/jonowego.
W cząsteczce tlenku siarki(IV) występuje 0/1/2 wiązania koordynacyjne. W wiązaniu koordynacyjnym wspólna para elektronowa pochodzi od jednego/dwóch z atomów tworzących to wiązanie. Donorem pary elektronowej jest atom o większej/mniejszej wartości elektroujemności względem wartości elektroujemności akceptora pary elektronowej. Wiązanie koordynacyjne jest wiązaniem typu kowalencyjnego/metalicznego/jonowego.
Zadania ciekawe (żeby nie pisać trudne 😉 ):
Zadanie 4.
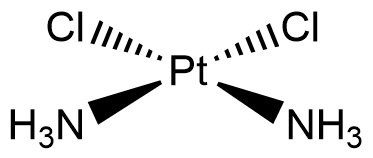
Cisplatyna jest nieorganicznym płaskim kompleksem, który posiada dwie pary identycznych ligandów ułożonych wokół centralnego jonu platyny. Ligandy te mogą być ułożone w pozycji cis (jednakowe ligandy obok siebie) lub trans (jednakowe ligandy położone są naprzeciw siebie).
Na podstawie przedstawionej informacji, narysuj wzór kompleksu cis-diaminadichloroplatyny(II):
Rozwiązanie:
cis-diaminadichloroplatyna(II): (LK = 4, diamina – dwie cząsteczki amoniaki, dichlowo-dwa aniony chlorkowe, cis – czyli zarówno aniony chlorkowe, jak i cząsteczki amoniaku są po tej samej stronie, plus mamy informację, że cząsteczka jest płaska).

Zadanie 5.
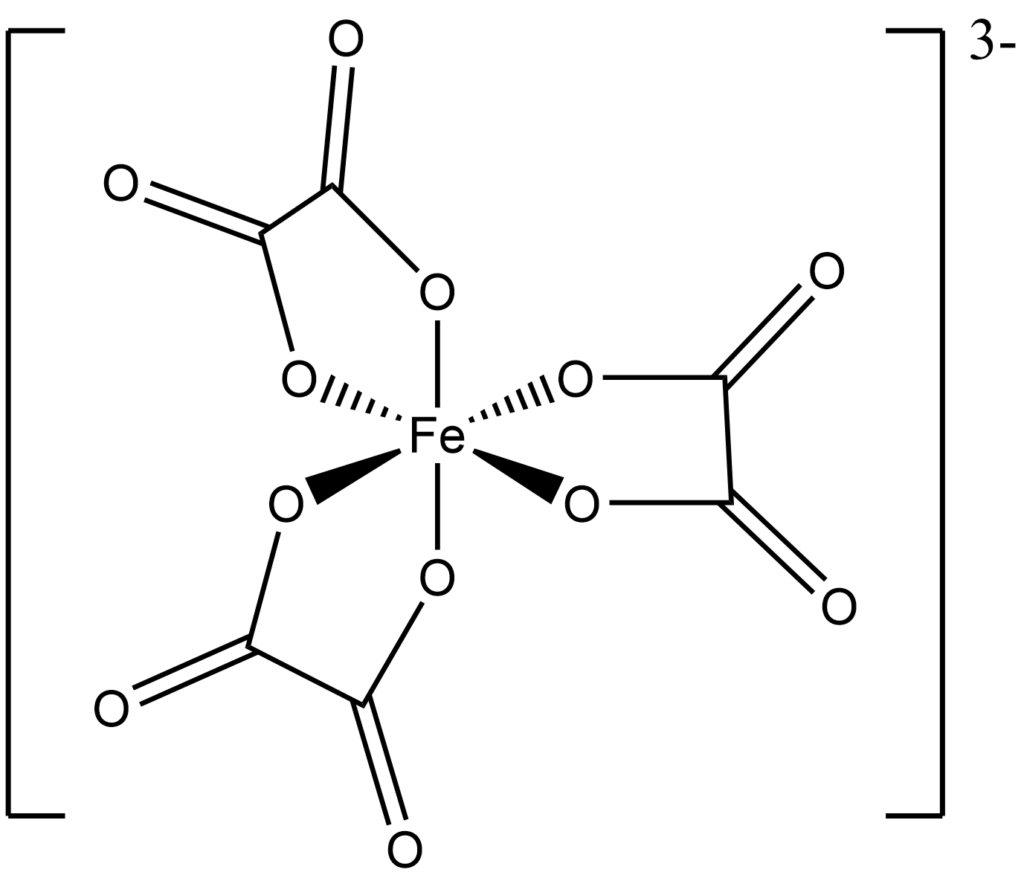
Kwas szczawiowy, a właściwie anion kwasu szczawiowego jest tak zwanym ligandem dwukleszczowym, co oznacza, że w związku kompleksowym zajmuje dwa znajdujące się obok siebie miejsca na ligandy.
Wiedząc, że z jonem żelaza(III) tworzy on związek kompleksowy o liczbie koordynacyjnej LK = 6, zaproponuj jego wzór półstrukturalny.
Rozwiązanie:
Jon centralny mamy na trzecim stopniu utlenienia więc 3+, mamy ligand dwuujemny dwukleszczowy, czyli sumarycznie gdy LK = 6 to będziemy mieli 3 cząsteczki ligandu, więc ladunek jonu kompleksowego wynosić będzie -3.
Aby narysować jon kompleksowy, rozrysuj 6 wiązań wychodzących od atomu centralnego, anion szczawianowy łączyć się w taki sposob aby zajac dwa sąsiadujące miejsca.