W oparciu o Wasze odpowiedzi, przygotowałam zestawienie z najczęściej popełnianymi przez Was błędami na maturze z chemii. Każdy z tych błędów został omówiony, a ponadto zostało zaproponowane do niego rozwiązanie, które można zastosować, by w przyszłości popełniać tych błędów jak najmniej.
1. Błędy rachunkowe
Z powyższym punktem można powiązać fakt, że jak sami uczniowie pisali: wszystko robią za szybko. Czyli… za szybko czytają, za szybko rozwiązują, nie doczytują poleceń lub z szybkości pomijają istotne informacje. W związku z powyższym, skutecznym rozwiązaniem na błędy rachunkowe może okazać się przede wszystkim próba opanowania tej szybkości. Owszem, na maturze z chemii uciekający czas nie jest sprzymierzeńcem żadnego maturzysty jednakże w „prostych” zadaniach na szybkości zwykle najwięcej się traci. Każda dodatkowa sekunda poświęcona na zgłębienie zadania pozwala znaleźć tak zwany „haczyk”, który przez pośpiech często umyka. Kluczem do opanowania pośpiechu jest ilość przerobionych matur NA CZAS. Jeśli ćwiczymy „pod presją”, ustalamy limit czasowy to zaczynamy się z tym limitem oswajać, wiemy ile tak naprawdę to jest 180 minut, które mamy do dyspozycji na maturze, a w konsekwencji jesteśmy bardziej precyzyjni w rozłożeniu poszczególnych zadań w czasie. Zatem RÓBCIE ARKUSZE MATURALNE Z CHEMII TAK JAKBYŚCIE PISALI MATURĘ ”NA ŻYWO”.


2. Błąd podczas wpisywania cyfr w kalkulator
Jak większość przedstawianych przez Was błędów, ten zwykle również wynika z pośpiechu. Jednakże tutaj znalezienie rozwiązania jest łatwiejsze, gdyż ważne jest by wpisywane działanie powtórzyć, ponieważ dzięki temu można się upewnić czy wynik, który ukazał się na kalkulatorze jest prawidłowy. Ponadto bardzo ważne jest to, by czynność tą wykonać podczas pierwszego rozwiązywanego działania, gdyż zazwyczaj pierwszy wynik jest potrzebny i używany do otrzymania wyniku ostatecznego. Mniej chemiczną, a bardziej praktyczną poradą jest nabycie kalkulatora z dużymi klawiszami, gdyż wówczas istnieje mniejsze ryzyko przypadkowego naciśnięcia błędnego klawisza. Zatem POWTÓRNIE SPRAWDZAJCIE WYNIK W KALKULATORZE I ZAOPATRZCIE SIĘ W WIĘKSZY KALKULATOR.


3. Brak odpowiedzi do zadania
W odpowiedziach z ankiety bardzo często pojawiała się informacja o tym, że zapominacie napisać odpowiedź do zadania. Pamiętajcie, że w zadaniach obliczeniowych pytanie końcowe nie dotyczy tylko i wyłącznie wyniku, ale również innych zagadnień związanych z daną tematyką. Dlatego warto podczas ostatecznego sprawdzania arkusza (które powinno być Waszym nawykiem!!!) zwrócić szczególną uwagę na to jakie pytanie zostało zadane w konkretnym poleceniu, a jakiej Wy udzieliliście odpowiedzi. To normalne, że podczas rozwiązywania chcecie jak najszybciej przejść do następnego zadania, dlatego GDY PRZEGLĄDACIE ARKUSZ NA SAM KONIEC CZYTAJCIE JESZCZE RAZ POLECENIE I WASZĄ ODPOWIEDŹ – wówczas łatwo zauważycie jeśli w ogóle jej nie udzieliliście.


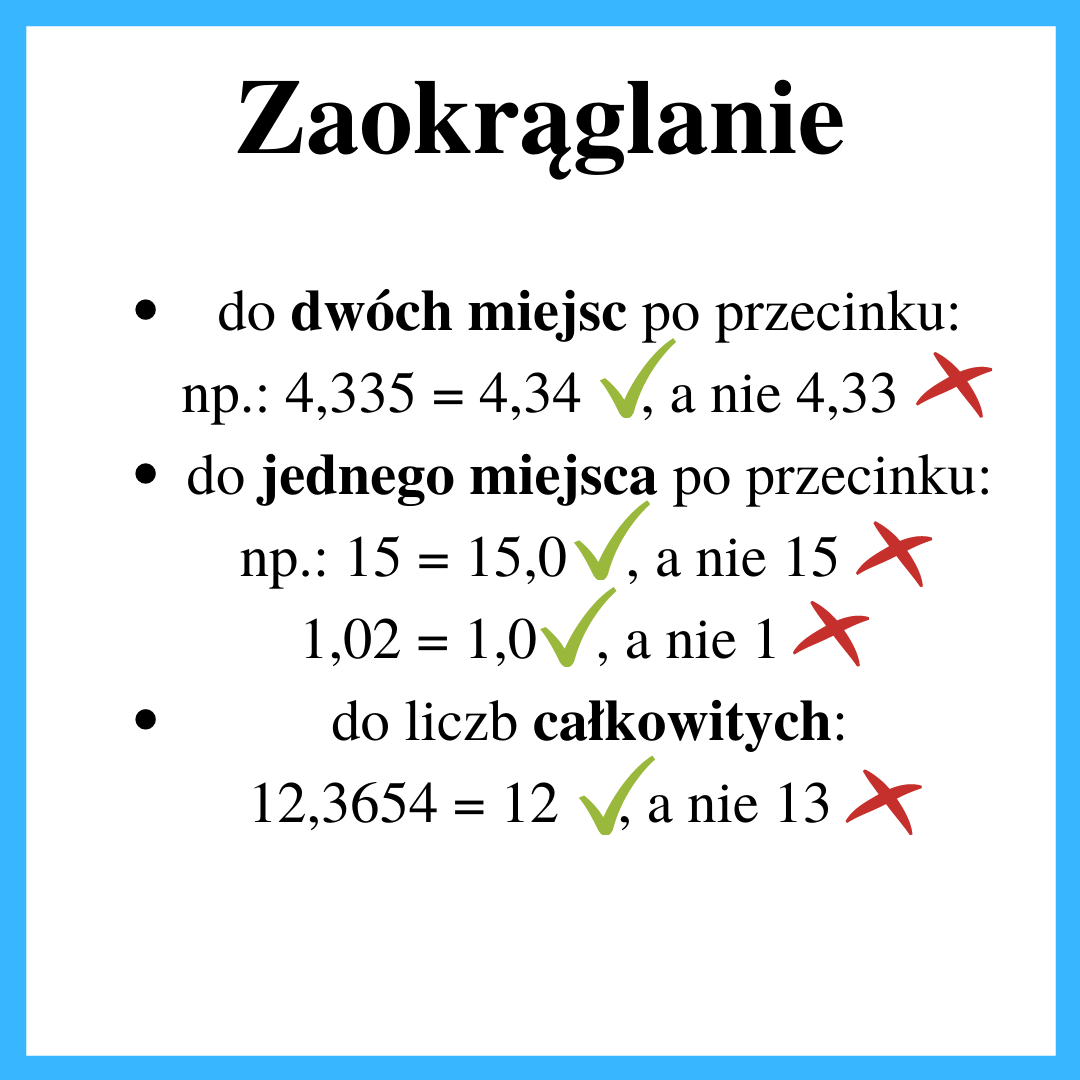
4. Błąd w zaokrągleniu/przybliżeniu
Przede wszystkim należy zwrócić uwagę na to, co jest napisane w poleceniu, czego się od nas oczekuje. Najlepiej jest podkreślić informacje o tym w jakim zaokrągleniu ma być podany wynik by pod koniec zadania coś przykuło naszą uwagę. Jeśli już otrzymaliśmy wynik i dane jest nam zmierzyć się z jego przybliżeniem trzeba pamiętać, że od wartości 5 włącznie, zaokrąglamy w górę. Np. chcemy wykonać przybliżenie liczby 4,335 do dwóch miejsc po przecinku, zatem będzie to 4,34, gdyż wartość 5 na końcu powoduje, że 3 podnosimy do 4.
0 (zero) to również „miejsce po przecinku”, zatem jeśli w zadaniu jest informacja, że należy zaokrąglić wynik do pierwszego miejsca po przecinku, a nasz wynik ma wartość 12, to należy dodać miejsce po przecinku mimo, że 12 to liczba całkowita. Dlatego prawidłowa odpowiedź w takim zadaniu to 12,0.

5. Błąd podczas obliczania masy i objętości cząsteczki
Wyżej wymieniony problem najczęściej pojawia się w kontekście cząsteczek dwuatomowych. Gdy w reakcji mamy do czynienia z cząsteczką tlenu to jej masa molowa będzie równa 32g/mol, a jej objętość w warunkach normalnych będzie wynosiła 22,4dm3 , gdyż nadal jest to jedna cząsteczka, z tym, że dwuatomowa. Można to zobrazować następująco:


W tym miejscu należy wspomnieć również o problemie z rozróżnianiem liczby moli, atomów i cząsteczek.
Dlatego poniżej pojawi się małe przypomnienie, które powinno co nieco rozjaśnić.
Jeśli dane jest 1,5 mola azotu cząsteczkowego, a pytają o:
- Liczbę moli cząsteczek azotu, to przykładowa odpowiedź powinna brzmieć: Powstaje 1,5 mola cząsteczek azotu.
- Liczbę cząsteczek azotu, to przykładowa odpowiedź powinna brzmieć: Powstaje 1,5 · 6,02·1023 cząsteczek azotu.
- Liczbę atomów azotu, to przykładowa odpowiedź powinna brzmieć: Powstaje 1,5· 2 · 6,02·1023 atomów azotu.
6. Brak jednostek i problem z ich zamianą
W pierwszej kolejności należy zwrócić uwagę w jakiej jednostce ma zostać podany wynik, gdyż to wielokrotnie zaoszczędzi nam wysiłku, który konieczny będzie do jej zamiany. Zatem jeśli dane są podane w kg i oczekiwany wynik również ma być podany w tej jednostce, jeśli nie jest to konieczne- warto jej nie zmieniać. Jeśli jednak musimy użyć jakiegoś wzoru, do którego wartości muszą zostać podane w konkretnie sprecyzowanej jednostce niezbędna jest ich zamiana. Warto zapamiętać liczbę 1000, gdyż to ona będzie najczęściej wykorzystywana podczas zamiany jednostek w zadaniach maturalnych. Podstawową zasadą jest, że gdy zmieniamy z jednostki większej na mniejszą to daną wartość mnożymy razy 1000 (np. 2kg = 2000g) a w odwrotnej sytuacji daną wartość dzielimy przez 1000 (np. 5cm3 = 0,005dm3 ALE 5g/cm3 = 5000g/dm3 !!!). Drugim zgłaszanym przez Was problemem jest całkowite zapominanie o jednostce podczas podawania wyniku. Wartościowym rozwiązaniem, jest pisanie jednostek podczas każdego wykonanego obliczenia, wówczas będą one cały czas widoczne i istnieje mniejsze ryzyko, że w ogóle ich nie zapiszecie. Dlatego WYKONUJĄC OBLICZENIA PRZY KAŻDEJ WARTOŚCI ZAPISUJCIE KONKRETNĄ JEDNOSTKĘ.


7. Niezapisywanie równań reakcji
Zapisanie równania reakcji w zadaniach (zwłaszcza obliczeniowych), które opisują przeprowadzenie jakiegoś doświadczenia, jest niemalże kluczem do ich rozwiązania. Pisząc równanie reakcji jesteśmy sobie w stanie wyobrazić jak zachodzi dana reakcja, widzimy reagenty, a przede wszystkim możemy ustalić w jakim stosunku reagują. Dzięki temu, w sytuacji gdy nie mamy pojęcia co zrobić, może nasunąć się pomysł, gdyż widoczne będzie to co trzeba policzyć a napisanie proporcji będzie zrozumiałe. Dlatego NIEZALEŻNIE OD TEGO CZY W POLECENIU WYMAGAJĄ RÓWNANIA REAKCJI, A JEST MOŻLIWE JEJ ZAPISANIE TO NALEŻY JĄ ZAPISAĆ, GDYŻ DZIĘKI TEMU DUŻO SZYBCIEJ I W PROSTSZY SPOSÓB BĘDZIE MOŻLIWE ROZWIĄZANIE ZADANIA.

8. Strach przed dużą ilością tekstu, strach że coś jest za trudne
Jeśli czytacie zadanie (zwłaszcza, które robicie pierwszy raz w życiu), jest ono obszerne, a informacje w nim zawarte są Wam zupełnie nieznane i wówczas czujecie strach TO NIC ZŁEGO. Jest to normalna reakcja organizmu w zetknięciu się z czymś nowym, zwłaszcza gdy dochodzi do tego stres spowodowany egzaminem i nieustająco uciekający czas na maturze. W takiej sytuacji przede wszystkim należy sobie zdać sprawę, że teraz już nie wrócę, nie mogę stąd uciec i jedyne co mogę zrobić to spróbować rozwiązać to zadanie najlepiej jak potrafię. Jednak, gdy strach dopada Was w domu to znaczy, że należy jeszcze bardziej oswoić się z zadaniami co równa się z tym, że należy ich robić więcej tak by ilość tekstu przestała być przerażająca. Zazwyczaj ta masa tekstu ma za zadanie Was wyprowadzić z równowagi, a tak naprawdę, by rozwiązać dane polecenie, wystarczy skorzystać tylko z jednej części tego opisu. Dlatego NAJLEPSZYM ROZWIĄZANIEM TEGO PROBLEMU JEST STARCIE Z WIĘKSZĄ ILOŚCIĄ ZADAŃ TYPU, KTÓRY JEST DLA WAS UCIĄŻLIWY. Pamiętajcie, że z tymi zadaniami to tak jak z oswajaniem wszystkiego co obce, na początku się tego boicie, a później jesteście kumplami.


9. Brak katalizatorów w równaniach reakcji
Błąd ten zazwyczaj pojawia się podczas pisania równań reakcji w chemii organicznej, gdyż jak to mówią „organiczna na katalizatorach stoi”. W związku z tym TRZEBA nauczyć się najbardziej charakterystycznych katalizatorów występujących w chemii organicznej. Jednakże, w części nieorganicznej również pojawiają się zadania wymagające zapisania odpowiedniego środowiska reakcji. Bardzo często autor zadania wspomina o tym w poleceniu ale nie wprost. Pisze np. o „zakwaszonym środowisku”, a nie o tym, że został wykorzystany dany katalizator. Dlatego ZAZNACZAJCIE W TEKŚCIE INFORMACJE O:
- KATALIZATORACH,
- WARUNKACH REAKCJI,
- TEMPERATURZE REKACJI.
Z KOLEI W CHEMII ORGANICZNEJ ZANIM ZAPISZECIE REAKCJĘ SPRÓBUJCIE ODTWORZYĆ CZY W TEJ KONKRETNEJ REAKCJI BYŁ POTRZEBNY KATALIZATOR.
10. Robienie zadań mechanicznie
Mechaniczność w wykonywaniu zadań oraz utrata czujność to również często zgłaszany przez Was problem. Rozwiązując arkusz maturalny NALEŻY PRZYJĄĆ, ŻE SĄ TO NOWE ZADANIA I W KAŻDYM Z NICH MOŻE BYĆ ZAWARTY HACZYK LUB INFORMACJA, KTÓRA POWINNA WZBUDZIĆ WASZE PODEJRZENIA. Fakt, że po przerobieniu wielu zadań doskwiera mechaniczność jest oznaką tego, że dobrze opanowaliście schematy rozwiązywania konkretnych zadań. Jednakże na każdej kolejnej maturze należy oczekiwać, że „coś” nie będzie schematyczne. Dlatego dobrze jest podchodzić do każdego zadania indywidualnie i starać się go rozłożyć na części pierwsze tak jakby było to zadanie, które widzicie po raz pierwszy. Doskonałym sposobem na to by nie utracić czujności jest robienie tzw. „zadań niematuralnych”. W nich rzadko pojawiają się schematyczne rozwiązania i czasem trzeba się bardzo nagłowić żeby rozwiązać takie zadanie.
11. Brak pomysłu od czego zacząć
Jeśli nie macie pomysłu co zrobić, jesteście w przysłowiowej kropce i nie możecie pójść na przód z rozwiązywaniem NALEŻY ZASTANOWIĆ SIĘ O CO NAS PYTAJĄ I CO NAM PODAJĄ. Dodatkowo po przeanalizowaniu danych dobrym sposobem jest wypisanie wzorów (jeśli korzystasz z wzorów) możliwych do wykorzystania, dzięki czemu można sprawdzić jakie wartości można otrzymać i czy są one przydatne do obliczenia wyniku.


12. Brak uzgodnienia współczynników reakcji
W jednym z powyższych punktów przedstawiona została istota zapisywania równania reakcji w poszczególnych zadaniach. Jeszcze większą rolę odgrywa ich uzgodnienie. Od uzgodnienia współczynników stechiometrycznych reakcji zależy wynik przeprowadzanych przez Was obliczeń dlatego też WASZYM NAWYKIEM POWINNO STAĆ SIĘ UZGADNIANIE REAKCJI ZARAZ PO ICH ZAPISANIU.
*Wszelkie prawa zastrzeżone. Kopiowanie bez zgody autora jest niedozwolone.
